根据图示回答下列问题: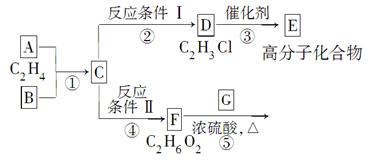

(1)写出A、E、G的结构简式:A:________,E______________________,G________;
(2)反应②的化学方程式(包括反应条件)是___________________;
反应④的化学方程式(包括反应条件)是___________________;
(3)写出①、⑤的反应类型:①________、⑤________。
(4)写出反应⑤的化学方程式:_________________________________。
根据图示回答下列问题:

(1)写出A、E、G的结构简式:A:________,E______________________,G________;
(2)反应②的化学方程式(包括反应条件)是___________________;
反应④的化学方程式(包括反应条件)是___________________;
(3)写出①、⑤的反应类型:①________、⑤________。
(4)写出反应⑤的化学方程式:_________________________________。