将下列物质按照要求由高到低的顺序排列
(1)NaF、NaCl、冰醋酸、SiC四种物质的熔沸点顺序: 。
(2)C、N、O三种元素的第一电离能: 。
(3)H2O的相对分子质量比H2S小,但沸点却高的原因 。
(4)某气态团簇分子的分子结构如图所示,其晶体的晶胞与CO2晶体的晶胞类型相同,则该团簇分子的分子式为 。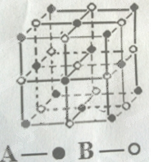
将下列物质按照要求由高到低的顺序排列
(1)NaF、NaCl、冰醋酸、SiC四种物质的熔沸点顺序: 。
(2)C、N、O三种元素的第一电离能: 。
(3)H2O的相对分子质量比H2S小,但沸点却高的原因 。
(4)某气态团簇分子的分子结构如图所示,其晶体的晶胞与CO2晶体的晶胞类型相同,则该团簇分子的分子式为 。