请根据官能团的不同对下列有机物进行分类。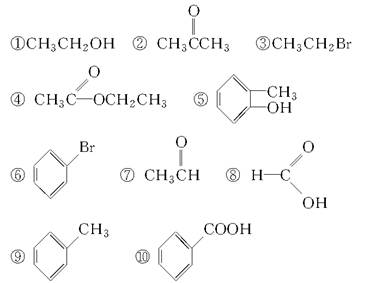
(1)芳香烃:______;(2)卤代烃:______;
(3)醇:______;(4)酚:________;(5)醛:________;
(6)酮:____________;(7)羧酸:____________;
(8)酯:______________。
请根据官能团的不同对下列有机物进行分类。
(1)芳香烃:______;(2)卤代烃:______;
(3)醇:______;(4)酚:________;(5)醛:________;
(6)酮:____________;(7)羧酸:____________;
(8)酯:______________。