某温度时,在2 L容器中,某一反应中A、B的物质的量随时间变化的曲线如下图所示,由图中数据分析得: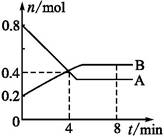
(1)在4 min末时,A、B的物质的量浓度c(A) c(B),从0~4 min内A、B的物质的量浓度变化量Δc(A) Δc(B)(以上填“>”“<”或“=”)。
(2)从反应开始至4 min时,A的平均反应速率为 。
(3)该反应的化学方程式为 。
某温度时,在2 L容器中,某一反应中A、B的物质的量随时间变化的曲线如下图所示,由图中数据分析得:
(1)在4 min末时,A、B的物质的量浓度c(A) c(B),从0~4 min内A、B的物质的量浓度变化量Δc(A) Δc(B)(以上填“>”“<”或“=”)。
(2)从反应开始至4 min时,A的平均反应速率为 。
(3)该反应的化学方程式为 。