有A、B两种常见化合物组成的混合物,其焰色反应均为黄色,其相互转化关系如图(其
他物质均略去)。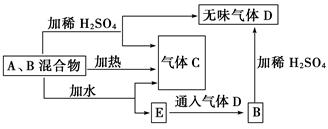
根据以上关系,回答下列问题:
(1)写出A、B、C、D的化学式:A________、B________,C________,D________。
(2)写出混合物中加水反应的化学方程式:_____________________________________
(3)加热后,若只得到一种固体化合物,则A与B的物质的量之比的最大值为________(填数字)。
有A、B两种常见化合物组成的混合物,其焰色反应均为黄色,其相互转化关系如图(其
他物质均略去)。
根据以上关系,回答下列问题:
(1)写出A、B、C、D的化学式:A________、B________,C________,D________。
(2)写出混合物中加水反应的化学方程式:_____________________________________
(3)加热后,若只得到一种固体化合物,则A与B的物质的量之比的最大值为________(填数字)。