下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢原子结合。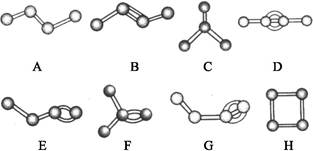
(1)图中属于烷烃的是 。(填编号)
(2)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成碳碳单键,还可以形成 和 ;不仅可以形成 ,还可以形成碳环。
(3)上图中互为同分异构体的是:A与 ;B与 ;D与 。(填编号)
下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢原子结合。
(1)图中属于烷烃的是 。(填编号)
(2)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成碳碳单键,还可以形成 和 ;不仅可以形成 ,还可以形成碳环。
(3)上图中互为同分异构体的是:A与 ;B与 ;D与 。(填编号)