防止钢铁的腐蚀是世界级难题,每年全世界钢产量的四分之一因腐蚀而损失,根据下图回答: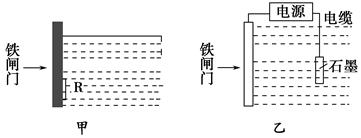
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为________________________。
(2)为降低某水库的铁闸门的被腐蚀速率,可以采用图甲方案,其中焊接在铁闸门上的固体材料R可以采用__________。
| A.铜 | B.钠 | C.锌 | D.石墨 |
(3)图乙所示方案也可降低铁闸门的被腐蚀速率,其中铁闸门应该连接在直流电源的________极。
防止钢铁的腐蚀是世界级难题,每年全世界钢产量的四分之一因腐蚀而损失,根据下图回答:
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为________________________。
(2)为降低某水库的铁闸门的被腐蚀速率,可以采用图甲方案,其中焊接在铁闸门上的固体材料R可以采用__________。
| A.铜 | B.钠 | C.锌 | D.石墨 |
(3)图乙所示方案也可降低铁闸门的被腐蚀速率,其中铁闸门应该连接在直流电源的________极。