氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下: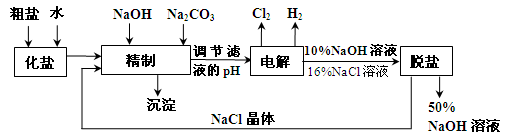
依据上图完成下列问题:
在电解过程中,阴极上生成气体的电子式为 。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 。
(3)精制过程要除去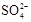 ,可选择下列溶液中的 (填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序)。
,可选择下列溶液中的 (填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去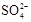 (已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: 。
(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: 。
(5)脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、(填操作名称)而制得50%的NaOH溶液。






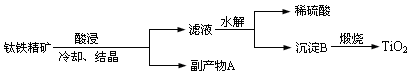
 R2Cu+2H+。则萃取和反萃取进行的程度受和的影响。
R2Cu+2H+。则萃取和反萃取进行的程度受和的影响。
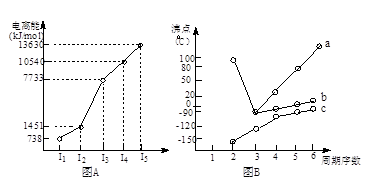
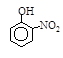

 粤公网安备 44130202000953号
粤公网安备 44130202000953号