按要求完成下列问题:
(1)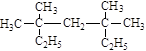 系统命名为 ;
系统命名为 ;
(2)写出间-甲基苯乙烯的结构简式 ;
(3)与H2加成生成 的炔烃的结构简式 ;
的炔烃的结构简式 ;
(4)羟基的电子式 ;
(5)写出4-甲基-2-乙基-1-戊烯的键线式 。
按要求完成下列问题:
(1)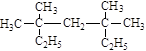 系统命名为 ;
系统命名为 ;
(2)写出间-甲基苯乙烯的结构简式 ;
(3)与H2加成生成 的炔烃的结构简式 ;
的炔烃的结构简式 ;
(4)羟基的电子式 ;
(5)写出4-甲基-2-乙基-1-戊烯的键线式 。