已知元素A、B、C、D、E、F均属前四周期,且原子序数依次增大, A的p能级电子数是s能级电子数的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能级层均排满,且最外层电子数为1。请回答下列问题:
(1)C原子基态时的电子排布式为 。
(2)B、C两种元素第一电离能为: ﹥ (用元素符号表示)。
试解释其原因: 。
(3)任写一种与AB- 离子互为等电子体的微粒 。
(4)B与C形成的四原子阴离子的立体构型为 ,其中B原子的杂化类型是 。
(5)D和E形成的化合物的晶胞结构如图,其化学式为 ,E的配位数是 ;已知晶体的密度为 ρ g·cm-3,阿伏加德罗常数为NA,则晶胞边长a= cm.(用含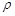 、NA的计算式表示)
、NA的计算式表示)
 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
 CH3Cl+HCl
CH3Cl+HCl ⑤CH3COOH+CH3CH2OH
⑤CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O 粤公网安备 44130202000953号
粤公网安备 44130202000953号