草酸亚铁晶体(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。回答下列问题:
I.兴趣小组对草酸亚铁晶体的分解产物进行实验和探究。探究分解得到的固体产物中铁元素的存在形式。
(1)提出假设
假设一:___________; 假设二:全部是FeO ; 假设三:FeO和Fe混合物。
(2)设计实验方案证明假设三。
| 实验步骤 |
现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 ,充分震荡 |
若溶液颜色明显改编,且有 生成,则证明有铁单质存在 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 |
|
| 步骤3:去步骤2得到少量固体与试管中,滴加 |
|
限选试剂:稀盐酸、新制的氯水、0.1mol.L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
Ⅱ.兴趣小组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为:_______________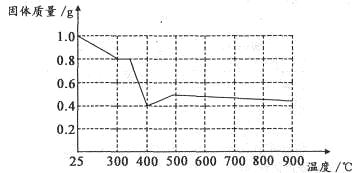
根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g。某同学由此得出结论:假设二不成立。你是否同意该同学的结论,并简述理由:______________________。









 粤公网安备 44130202000953号
粤公网安备 44130202000953号