如图,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。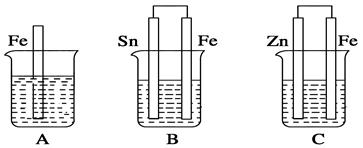
(1)A中反应的离子方程式为_____________________________。
(2)B中Sn极的电极反应式为____________________________。
(3)C中被腐蚀的金属是________,总反应的化学方程式为_____________________。比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为__________。
(填序号)。
如图,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为_____________________________。
(2)B中Sn极的电极反应式为____________________________。
(3)C中被腐蚀的金属是________,总反应的化学方程式为_____________________。比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为__________。
(填序号)。