某化学兴趣小组为了粗略测定一批石灰石样品中CaCO3的质量分数,设计并进行如下实验。
实验装置如图所示,称取研细的2.60g石灰石样品,分4次加入稀盐酸,充分反应至不再产生气体为止。测得反应前后的有关质量如表: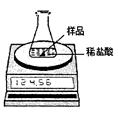
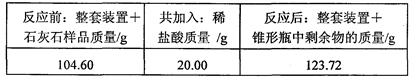
(1)计算石灰石样品中CaCO3的质量分数。
(2)若在上述实验过程中石灰石样品和所加酸液均无抛洒,根据图中装置判断,该实验结果可能 (填“偏大”、“偏小”或“准确”),原因是 。
某化学兴趣小组为了粗略测定一批石灰石样品中CaCO3的质量分数,设计并进行如下实验。
实验装置如图所示,称取研细的2.60g石灰石样品,分4次加入稀盐酸,充分反应至不再产生气体为止。测得反应前后的有关质量如表:

(1)计算石灰石样品中CaCO3的质量分数。
(2)若在上述实验过程中石灰石样品和所加酸液均无抛洒,根据图中装置判断,该实验结果可能 (填“偏大”、“偏小”或“准确”),原因是 。