铁及其化合物之间的相互转化可用下式表示: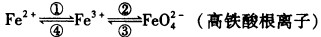
回答下列有关问题:
(1)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是 。
(2)检验硫酸铁溶液中是否存在Fe2+的方法是
(3)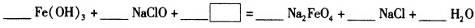
(4)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+。Na2FeO4之所以能净水,除了能消毒杀菌外,另一个原因是(结合离子方程式说明) 。
铁及其化合物之间的相互转化可用下式表示: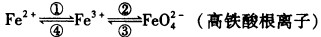
回答下列有关问题:
(1)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是 。
(2)检验硫酸铁溶液中是否存在Fe2+的方法是
(3)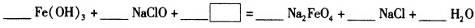
(4)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+。Na2FeO4之所以能净水,除了能消毒杀菌外,另一个原因是(结合离子方程式说明) 。