某Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸,测得溶液中的C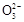 、HC
、HC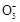 、Al
、Al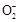 、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是( )
、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是( )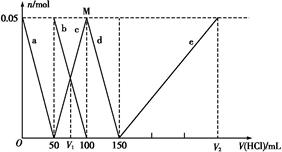
A.原混合溶液中的C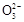 与Al 与Al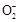 的物质的量之比为1∶2 的物质的量之比为1∶2 |
| B.V1∶V2=1∶5 |
| C.M点时生成的CO2为0.05 mol |
D.a线表示的离子方程式为:Al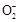 +H++H2O +H++H2O Al(OH)3↓ Al(OH)3↓ |
某Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸,测得溶液中的C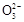 、HC
、HC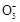 、Al
、Al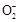 、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是( )
、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是( )
A.原混合溶液中的C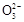 与Al 与Al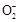 的物质的量之比为1∶2 的物质的量之比为1∶2 |
| B.V1∶V2=1∶5 |
| C.M点时生成的CO2为0.05 mol |
D.a线表示的离子方程式为:Al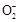 +H++H2O +H++H2O Al(OH)3↓ Al(OH)3↓ |