某厂排放的废水中含有碳酸钠,易造成环境污染。化学兴趣小组为该厂设计废水处理和利用的方案.讲行了如下实验:取过滤后的水样200 g,逐滴加入稀盐酸至恰好不再产生气体为止,反应过程中生成气体与所加稀盐酸的质量关系如图所示。请回答下列问题(不考虑水样中杂质的影响):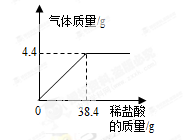
(I)反应生成C02气体的质量是 g;
(2)反应后生成氯化钠的质量是多少?(写出计算过程)
(3)农业上常用10%一20%的氯化钠溶液来选种。请通过列式计算判断:上述实验反应后所得溶液能否直接用于农业上选种?
某厂排放的废水中含有碳酸钠,易造成环境污染。化学兴趣小组为该厂设计废水处理和利用的方案.讲行了如下实验:取过滤后的水样200 g,逐滴加入稀盐酸至恰好不再产生气体为止,反应过程中生成气体与所加稀盐酸的质量关系如图所示。请回答下列问题(不考虑水样中杂质的影响):
(I)反应生成C02气体的质量是 g;
(2)反应后生成氯化钠的质量是多少?(写出计算过程)
(3)农业上常用10%一20%的氯化钠溶液来选种。请通过列式计算判断:上述实验反应后所得溶液能否直接用于农业上选种?