对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )。
2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )。
| |
A |
B |
| 研究 目的 |
压强对反应的影 响(p2>p1) |
温度对反应的影响 |
| 图示 |
 |
 |
| 研究 目的 |
平衡体系增加N2 对反应的影响 |
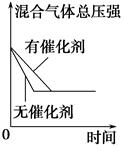
催化剂对反应的影响 |
| 图示 |
 |
 |
对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )。
2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )。
| |
A |
B |
| 研究 目的 |
压强对反应的影 响(p2>p1) |
温度对反应的影响 |
| 图示 |
 |
 |
| 研究 目的 |
平衡体系增加N2 对反应的影响 |
催化剂对反应的影响 |
| 图示 |
 |
 |