工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)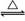 Si3N4(s)+12HCl(g) ΔH<0
Si3N4(s)+12HCl(g) ΔH<0
某温度和压强条件下,分别将0.3 mol SiCl4(g)、0.2 mol N2(g)、0.6 mol H2(g)充入2 L密闭容器内,进行上述反应,5 min达到平衡状态,所得Si3N4(s)的质量是5.60 g。
(1)H2的平均反应速率是 mol·L-1·min-1。
(2)平衡时容器内N2的浓度是 mol·L-1。
(3)SiCl4(g)的转化率是 。
(4)若按n(SiCl4)∶n(N2)∶n(H2)=3∶2∶6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应 (填“增大”“减小”或“不变”)。
(5)在不改变反应条件的情况下,为了提高SiCl4(g)的转化率,可通过改变投料配比的方式来实现。下列四种投料方式,其中可行的是 。
| 选项 |
投料方式 |
| A |
n(SiCl4)∶n(N2)∶n(H2)=1∶1∶2 |
| B |
n(SiCl4)∶n(N2)∶n(H2)=" " 1∶2∶2 |
| C |
n(SiCl4)∶n(N2)∶n(H2)=" " 3∶2∶2 |
| D |
n(SiCl4)∶n(N2)∶n(H2)=" " 2∶1∶3 |
(6)达到平衡后升高温度,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c(HCl)减少
B.正反应速率减慢,逆反应速率加快
C.Si3N4的物质的量减小
D.重新平衡时c(H2)/c(HCl)增大


 粤公网安备 44130202000953号
粤公网安备 44130202000953号