A1-H2O2电池功率大,可作为许多机械的动力电池,其结构如图所示。下列说法不正确的是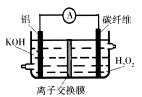
| A.铝作负极,电池工作时将不断溶解 |
| B.该电池不是二次电池,不可充电 |
| C.碳纤维电极的电极反应是H2O2+2 e一+2H+ =" 2" H2O |
| D.电池工作时OH一从碳纤维电极透过离子交换膜移向Al电极 |
A1-H2O2电池功率大,可作为许多机械的动力电池,其结构如图所示。下列说法不正确的是
| A.铝作负极,电池工作时将不断溶解 |
| B.该电池不是二次电池,不可充电 |
| C.碳纤维电极的电极反应是H2O2+2 e一+2H+ =" 2" H2O |
| D.电池工作时OH一从碳纤维电极透过离子交换膜移向Al电极 |