常温下,0.1 mol·L-1某一元酸(HA)溶液中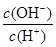 =10-8,下列叙述正确的是
=10-8,下列叙述正确的是
A.该一元酸溶液的pH=1
B.该溶液中由水电离出的H+浓度为c(H+)=1.0×10-11 mol·L-1
C.该溶液中水的离子积常数为1.0×10-22
D.在0.1 mol·L-1某一元酸(HA)溶液中,水的电离被促进
常温下,0.1 mol·L-1某一元酸(HA)溶液中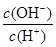 =10-8,下列叙述正确的是
=10-8,下列叙述正确的是
A.该一元酸溶液的pH=1
B.该溶液中由水电离出的H+浓度为c(H+)=1.0×10-11 mol·L-1
C.该溶液中水的离子积常数为1.0×10-22
D.在0.1 mol·L-1某一元酸(HA)溶液中,水的电离被促进