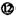“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
请根据要求在下列横线上填上合适的序号
(1)在迷宫中不能与稀盐酸反应的物质:属于电解质的是_______________,属于非电解质的是______________。
(2)在迷宫中的物质,能与稀盐酸发生氧化还原反应的是
(3)请你帮助它走出迷宫HCl——___—____—____—___—
“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
请根据要求在下列横线上填上合适的序号
(1)在迷宫中不能与稀盐酸反应的物质:属于电解质的是_______________,属于非电解质的是______________。
(2)在迷宫中的物质,能与稀盐酸发生氧化还原反应的是
(3)请你帮助它走出迷宫HCl——___—____—____—___—