工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。
(1)某温度下,2SO2(g)+O2(g) 2SO3(g) △H="-197" kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。
2SO3(g) △H="-197" kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生下列反应: 2SO2(g)+O2(g) 2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是 (填字母)。
2SO2(g)+O2(g) 2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是 (填字母)。
A.恒温恒容,充入2mol SO3 B.恒温恒容,充入2mol N2
C.恒温恒压,充入1 mol SO3 D.升高温度
(3)在一密闭容器中进行下列反应:2SO2(g)+O2(g) 2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。
2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。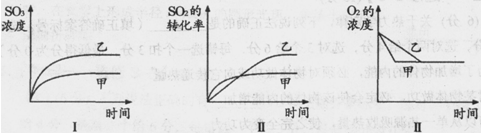
A.图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且乙的温度较低
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
(4)某实验小组设想如下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式: 。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
SO2(g)+O2(g) 2SO3(g) △H1="-197" kJ/mol;
2SO3(g) △H1="-197" kJ/mol;
H2O(g)=H2O(1) △H2="-44" kJ/mol:
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(1) H3="-545" kJ/mol。
写出SO3(g)与H2O(1)反应的热化学方程式是 。
(6)由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,SO42-和CO32-的浓度之比 。[已知该温度时,Ksp(BaSO4)=1.3x10-10,KsP(BaCO3)=5.2x10-9]。
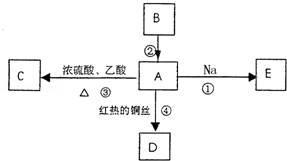

 ,D在同周期元素中原子半径最小,据此填空:
,D在同周期元素中原子半径最小,据此填空: 粤公网安备 44130202000953号
粤公网安备 44130202000953号