工业制硝酸的主要反应是:4NH3(g)+5O2(g) 4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol
4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol
(1)一定温度下,现将0.8mol NH3和1.5mol O2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 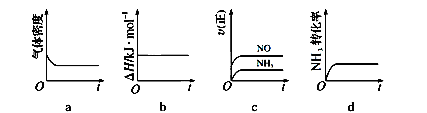
(2)在容积为1L的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
| 起始 |
0.8 |
1.5 |
0 |
| 第2min |
0.7 |
a |
0.1 |
| 第4min |
0.4 |
1.0 |
0.4 |
| 第6min |
0.4 |
1.0 |
0.4 |
| 第8min |
1.2 |
2.5 |
0.4 |
①起始时物料比c (O2) : c (NH3)>1.25,其原因是
②反应在第2min到第4min时O2的平均反应速率为 mol·L-1·min-1
③反应在第2min改变了反应条件,改变的条件可能是 (填字母序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是 ,再次达到平衡时,NO的体积分数
(填“增大”、“减小”或“不变”)
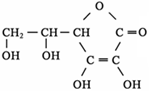

 )在一定条件下可以按物质的量1∶1发生反应生成高分子化合物,该高分子化合物的结构简式为____________________________。
)在一定条件下可以按物质的量1∶1发生反应生成高分子化合物,该高分子化合物的结构简式为____________________________。 )为原料先生产苯酐(
)为原料先生产苯酐( ),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为_______________。
),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为_______________。 O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1 O2(g)===CO2(g)ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g)ΔH=-283.0 kJ·mol-1 CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1

 粤公网安备 44130202000953号
粤公网安备 44130202000953号