甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”).
②在其他条件不变得情况下,考察温度对反应II的影响,实验结果如图所示
由图中数据判断 ΔH2 0 (填“>”,“=”或“<”).
③某温度下,将2 mol CO2和6 mol H2充入2L的密闭容器中,发生反应II,达到平衡后,测得c(CO2)= 0.2 mol/L, 则此时容器中的压强为原来的 倍
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为 。
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池负极的电极反应为
②此电池消耗甲醇1.6克时,反应中电子转移数目为
③若以此燃料电池为铅蓄电池充电,则应将图中右侧电极连接蓄电池的 (填正极或负极)

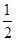 O2(g)===CO(g)ΔH2=-Q1kJ·mol-1
O2(g)===CO(g)ΔH2=-Q1kJ·mol-1
 2NO2(g);DH>0的平衡体系中,在298K时,平衡常数为K1,在273K时,平衡常数为K2,在373K时平衡常数为K3,K1、K2、K3之间的数量大小关系是 。
2NO2(g);DH>0的平衡体系中,在298K时,平衡常数为K1,在273K时,平衡常数为K2,在373K时平衡常数为K3,K1、K2、K3之间的数量大小关系是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号