常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 moI/L NaOH溶液。有关微粒的物质的量变化如下图所示(其中I代表H2A,Ⅱ代表HAˉ,Ⅲ代表A2ˉ),根据图示判断,下列说法正确的是( )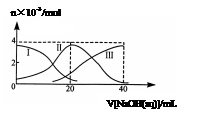
| A.当V[NaOH(aq)] ="20" mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)>c(A2ˉ)>c(OHˉ) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为:H2A= HAˉ +H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减少 |
 化还原反应说法正确的是
化还原反应说法正确的是 水,最好采用下列何种方法分
水,最好采用下列何种方法分 离
离
 粤公网安备 44130202000953号
粤公网安备 44130202000953号