电离度表示电解质的相对强弱,电离度的定义:
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%。
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1 mol·L-1)如下表:
| 编号 |
物质(微粒) |
电离度α |
| A |
硫酸溶液(第一步完全电离): 第二步 HSO4- H++SO42- H++SO42- |
10% |
| B |
硫酸氢钠溶液: HSO4- H++SO42 H++SO42 |
29% |
| C |
醋酸: CH3COOH CH3COO-+H+ CH3COO-+H+ |
1.33% |
| D |
盐酸: HCl=H++Cl- |
100% |
(1)25℃时,0.1 mol·L-1上述几种溶液中,c(H+)从大到小的顺序是 (填序号);
(2)25℃时,0.1 mol·L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1 mol·L-1硫酸氢钠
溶液中HSO4-的电离度,其原因是 。
(3)醋酸的电离平衡常数K的表达式是 ,醋酸的电离平衡常数
K与电离度α的关系式为:K= (用含α的代数式表示)
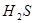 溶于水的电离方程式为___________________________。
溶于水的电离方程式为___________________________。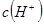 _________(填增大、减小、不变),
_________(填增大、减小、不变),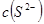 _________(填增大、减小、不变)。
_________(填增大、减小、不变)。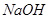 固体,电离平衡向_________移动,
固体,电离平衡向_________移动,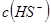 增大,且使
增大,且使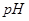 _________(填增大、减小、不变)
_________(填增大、减小、不变)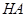 配制
配制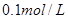 的溶液
的溶液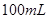 ;
;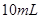 ,加水稀释为
,加水稀释为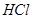 溶液的试管中放出
溶液的试管中放出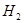 的速率快;
的速率快;

 达到平衡:
达到平衡: 、y、z间的关系是________________;
、y、z间的关系是________________; ,在增大压强时,若平衡发生移动,则一定向________(填“正”或“逆”)反应方向移动;
,在增大压强时,若平衡发生移动,则一定向________(填“正”或“逆”)反应方向移动; 电离度
电离度 的数值,其实验方案可设计如下:
的数值,其实验方案可设计如下: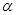 __________。
__________。 粤公网安备 44130202000953号
粤公网安备 44130202000953号