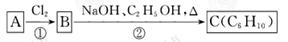某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢原子。
(1)A的结构简式为 ;
(2)已知A、B、C有下列转化关系,则反应②的化学方程式为 ;
C的化学名称为 。 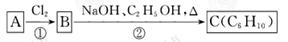
某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢原子。
(1)A的结构简式为 ;
(2)已知A、B、C有下列转化关系,则反应②的化学方程式为 ;
C的化学名称为 。