研究NO2、、CO等大气污染气体的处理具有重要意义。
利用反应6NO2(g)+8NH3(g)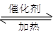 7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
| 反应时间/min |
n(NO2)/mol |
n(NH3)/ mol |
| 0 |
1.20 |
1.60 |
| 2 |
0.90 |
|
| 4 |
|
0.40 |
(1)反应在2min内的平均速率为v(NH3)=
4min该反应达到平衡状态,则该反应的平衡常数K的表达式为 ,NO2的转化率为
(2) 700℃ ,将NO2与NH3以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.体系密度保持不变 d.每消耗1 mol NO2的同时生成2 mol H2O
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。200℃时,向在一个带活塞的密闭真空容器中中充入一定量的CO和H2发生上述反应,压缩容器的容积为原来的一半,平衡将 移动(填向左,向右,不);CO的浓度将 (增大,减小,不变)
CH3OH(g)。200℃时,向在一个带活塞的密闭真空容器中中充入一定量的CO和H2发生上述反应,压缩容器的容积为原来的一半,平衡将 移动(填向左,向右,不);CO的浓度将 (增大,减小,不变)


 CH4 (g)+2H2O(g)
CH4 (g)+2H2O(g)

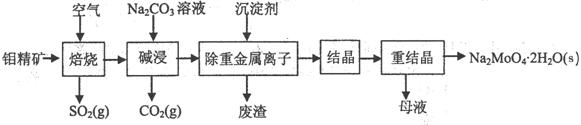 (1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________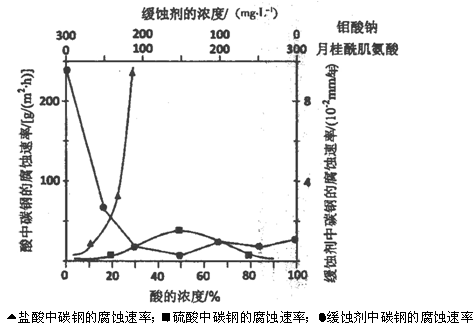
 Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。 物质
物质
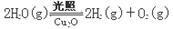 ΔH >0
ΔH >0 CH3CH2OH+CH3COOH。
CH3CH2OH+CH3COOH。 粤公网安备 44130202000953号
粤公网安备 44130202000953号