根据表中信息回答下列问题。
| 元素 |
Si |
P |
S |
Cl |
| 单质与氢气 反应的条件 |
高温 |
磷蒸气与氢气能反应 |
加热 |
光照或点燃时发生爆炸而化合 |
(1)S在元素周期表中的位置是 。
(2)根据表中信息可知,Si、P、S、Cl 四种元素的的非金属性依次增强。用原子结构解释原因:同周期元素电子层数相同,从左至右, ,原子半径逐渐减小,得电子能力逐渐增强。
(3)25℃时,以上四种元素的单质与氢气反应生成l mol气态氢化物的反应热如下:
a.+34.3 kJ·mol-1 b.+9.3 kJ·mol-1 c.−20.6 kJ·mol-1 d.−92.3 kJ·mol-1
请写出固态白磷(P4)与H2反应生成气态氢化物的热化学方程式 。
(4)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。已知硒(Se)是人体必需的微量元素,其部分信息如图。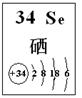
①下列有关说法正确的是 (填字母)。
a. 原子半径:Se>S>P b. 稳定性:H2Se>H2S
c. 因为酸性H2Se<HCl,所以非金属性Se<Cl
d. SeO2是酸性氧化物,能与烧碱溶液反应
②在下表中列出对H2SeO3各种不同化学性质的推测,举例并写出相应的化学方程式。
| 编号 |
性质推测 |
化学方程式 |
| 1 |
氧化性 |
H2SeO3+4HI=Se↓+2I2+3H2O |
| 2 |
|
|
| 3 |
|
|


 、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式
、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式
 粤公网安备 44130202000953号
粤公网安备 44130202000953号