维生素C的结构简式如下图,它的分子式是______________。由于它能防治坏血病,又称为_________________。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有__________性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是______________,说明维生素C具有_________ 性。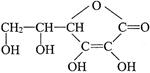
维生素C的结构简式如下图,它的分子式是______________。由于它能防治坏血病,又称为_________________。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有__________性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是______________,说明维生素C具有_________ 性。