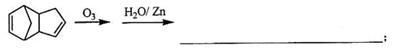金刚烷是一种重要的化工原料,工业上可通过下列途径制备: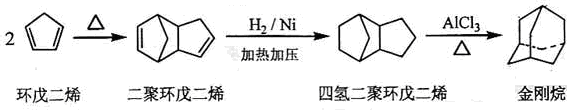
请回答下列问题:
(1)金刚烷的分子式为 ,其分子中的CH2基团有 个;
(2)下面是以环戊烷为原料制备环戊二烯的合成路线: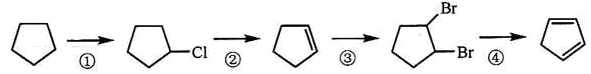
其中,反应①的反应试剂是 ,反应③的方程式 ,反应④的反应类型是 ;
(3)已知烯烃能发生如下的反应: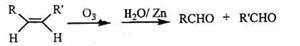
请写出下列反应产物的结构简式: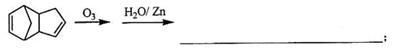
金刚烷是一种重要的化工原料,工业上可通过下列途径制备:
请回答下列问题:
(1)金刚烷的分子式为 ,其分子中的CH2基团有 个;
(2)下面是以环戊烷为原料制备环戊二烯的合成路线:
其中,反应①的反应试剂是 ,反应③的方程式 ,反应④的反应类型是 ;
(3)已知烯烃能发生如下的反应: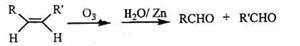
请写出下列反应产物的结构简式: