常温下,如果取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(忽略混合后
溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因: (用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+) (填“>”“<”或“=”)0.1 mol/L NaOH
溶液中由水电离出的c(H+)。
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)= mol/L,
c(OH-)-c(HA) = mol/L。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3
溶液的pH (填“大于”“小于”或“等于”)7;将同温度下等浓度的四
种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列是 (填序号)。
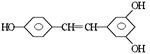 ,广泛存在于食物(例如桑椹、花生,尤其是葡萄)中。它可能具有抗癌性。该物质和溴水或 氢气反应时,能够跟1 mol 该化合物起反应的Br2或H2的最大用量分别是mol。
,广泛存在于食物(例如桑椹、花生,尤其是葡萄)中。它可能具有抗癌性。该物质和溴水或 氢气反应时,能够跟1 mol 该化合物起反应的Br2或H2的最大用量分别是mol。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号