氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取,反应原理如下:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)若制得标准状况下11.2 L Cl2,则被氧化的HCl为___________mol。
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为__________。
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
①步骤Ⅰ中, 试剂甲必须具有的性质是____________(填序号)。
A.氧化性B.还原性C.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL,该反应的离子方程式为___________________________。
(4)用100mL12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30 mol,请你分析可能的原因为___________________________。
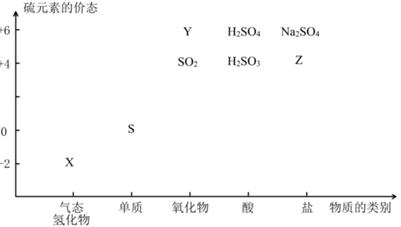
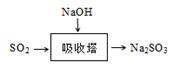 。
。 S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是(填写字母序号)。
S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是(填写字母序号)。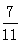 ,则SO2的转化率为。
,则SO2的转化率为。 3Ba↑+BaO·Al2O3,用化学平衡移动原理解释上述方法可制取金属Ba的原因是。
3Ba↑+BaO·Al2O3,用化学平衡移动原理解释上述方法可制取金属Ba的原因是。 2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示: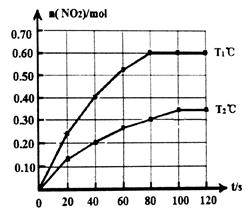
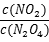 的比值变小,可采取的措施有__________(填序号)。
的比值变小,可采取的措施有__________(填序号)。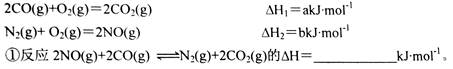
 (n可以为零)将NO2变成无害N2,若要求X必须为无污染的物质,则G可以是_________(填写字母)。
(n可以为零)将NO2变成无害N2,若要求X必须为无污染的物质,则G可以是_________(填写字母)。
 CH4(g)+2H2O(g) △H="-162" kJ·mol-1。其他条件相同,实验测得在T1和Pl与T2和P2条件下该反应的H2平衡转化率相同,若T1> T2、则Pl ____P2 (填“>”“<”或“=”),平衡常数K1______K2(填“>” “<”或“=”)。
CH4(g)+2H2O(g) △H="-162" kJ·mol-1。其他条件相同,实验测得在T1和Pl与T2和P2条件下该反应的H2平衡转化率相同,若T1> T2、则Pl ____P2 (填“>”“<”或“=”),平衡常数K1______K2(填“>” “<”或“=”)。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号