下图甲中电极均为石墨电极,下列叙述中正确的是( )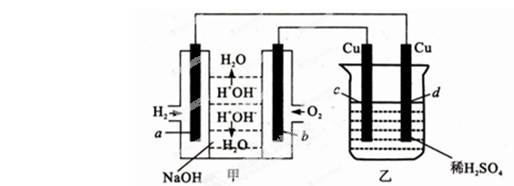
| A.电子沿a→d→c→b路径流动 |
| B.b极的电极反应为;O2+4e-+4H+=2H2O |
C.通电初期乙中的总反应为Cu+H2SO4  CuSO4+H2↑ CuSO4+H2↑ |
| D.反应过程中,甲、乙装置中溶液的pH都逐渐减小 |
下图甲中电极均为石墨电极,下列叙述中正确的是( )
| A.电子沿a→d→c→b路径流动 |
| B.b极的电极反应为;O2+4e-+4H+=2H2O |
C.通电初期乙中的总反应为Cu+H2SO4  CuSO4+H2↑ CuSO4+H2↑ |
| D.反应过程中,甲、乙装置中溶液的pH都逐渐减小 |