甲醇(CH3OH)燃料电池可用作电动汽车电源,下图为电池示意图。在电池的一极通入甲醇,另一极通入氧气,工作时H+由负极移向正极。下列叙述不正确的是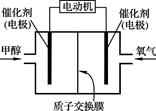
| A.外电路通过0.6 mol电子时,理论上消耗甲醇3.2 g |
| B.通甲醇一端为负极 |
| C.正极反应为:O2+4H++4e-= 2H2O |
| D.负极反应为:CH3OH+H2O+6e-= CO2↑+6H+ |
甲醇(CH3OH)燃料电池可用作电动汽车电源,下图为电池示意图。在电池的一极通入甲醇,另一极通入氧气,工作时H+由负极移向正极。下列叙述不正确的是
| A.外电路通过0.6 mol电子时,理论上消耗甲醇3.2 g |
| B.通甲醇一端为负极 |
| C.正极反应为:O2+4H++4e-= 2H2O |
| D.负极反应为:CH3OH+H2O+6e-= CO2↑+6H+ |