在一定条件下,可逆反应:mA+nB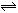 pC达到平衡,若:
pC达到平衡,若:
(1) A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的大小关系是 ;
(2) A、C是气体,若增加B的量,平衡不移动,则B应为 态;
(3) A、C是气体,而且m+n = p,增大压强可使平衡发生移动,则平衡移动的方向必是 。
(4) 加热后,可使C的质量增加,则正反应是 反应(选填“放热”或“吸热”)。
在一定条件下,可逆反应:mA+nB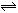 pC达到平衡,若:
pC达到平衡,若:
(1) A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的大小关系是 ;
(2) A、C是气体,若增加B的量,平衡不移动,则B应为 态;
(3) A、C是气体,而且m+n = p,增大压强可使平衡发生移动,则平衡移动的方向必是 。
(4) 加热后,可使C的质量增加,则正反应是 反应(选填“放热”或“吸热”)。