普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出空间构型)。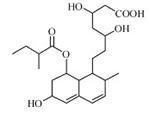
试填空:
(1)该有机物分子中的含氧官能团是 。(填名称)
(2)该有机物的分子式为 。
(3)该有机物能发生 反应。(请填序号)
a.取代反应 b.消去反应 c.加成反应
(4)1 mol该有机物与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠 mol。
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出空间构型)。
试填空:
(1)该有机物分子中的含氧官能团是 。(填名称)
(2)该有机物的分子式为 。
(3)该有机物能发生 反应。(请填序号)
a.取代反应 b.消去反应 c.加成反应
(4)1 mol该有机物与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠 mol。