阿立哌唑(A)是一种新的抗精神分裂症药物,可由化合物B、C、D在有机溶剂中通过以下两条路线合成得到。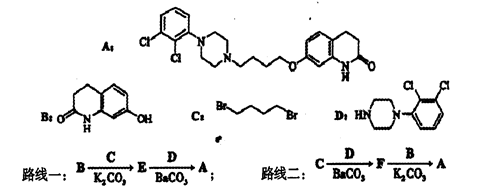
(1)E的结构简式为___________。
(2)由C、D生成化合物F的反应类型是___________。
(3)合成F时还可能生成一种相对分子质量为285的副产物G,G的结构简式为______________。
(4)H属于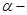 氨基酸,与B的水解产物互为同分异构体。H能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2种。写出两种满足上述条件的H的结构简式:__________。
氨基酸,与B的水解产物互为同分异构体。H能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2种。写出两种满足上述条件的H的结构简式:__________。
阿立哌唑(A)是一种新的抗精神分裂症药物,可由化合物B、C、D在有机溶剂中通过以下两条路线合成得到。
(1)E的结构简式为___________。
(2)由C、D生成化合物F的反应类型是___________。
(3)合成F时还可能生成一种相对分子质量为285的副产物G,G的结构简式为______________。
(4)H属于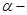 氨基酸,与B的水解产物互为同分异构体。H能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2种。写出两种满足上述条件的H的结构简式:__________。
氨基酸,与B的水解产物互为同分异构体。H能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2种。写出两种满足上述条件的H的结构简式:__________。