从环己烷可制备1,4-环己二醇的二醋酸酯。下面是有关的8步反应(其中所有无机产物都已略去):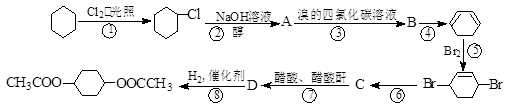
(1)化合物B、C的结构简式:B 、C ;
(2)属于取代反应分别是是反应①、 、 ;(填序号)
(其中有3步属于取代反应、2步属于消去反应、3步属于加成反应)
(3)反应④的化学反应方程式为 ;该反应类型为 。
从环己烷可制备1,4-环己二醇的二醋酸酯。下面是有关的8步反应(其中所有无机产物都已略去):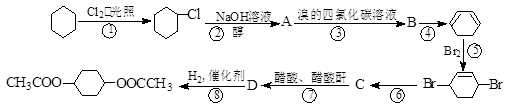
(1)化合物B、C的结构简式:B 、C ;
(2)属于取代反应分别是是反应①、 、 ;(填序号)
(其中有3步属于取代反应、2步属于消去反应、3步属于加成反应)
(3)反应④的化学反应方程式为 ;该反应类型为 。