(14分)工业制硝酸的主要反应是4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
(1)如果将4molNH3和5molO2放入容器中,达到平衡时,放出热量0.8akJ,则反应时转移的电子数为
mol
(2)若其他条件不变,下列关系图中错误的是 (选填序号)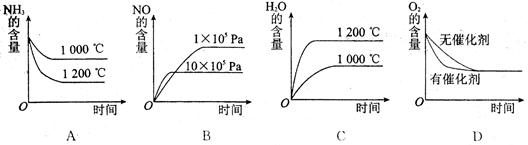
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表
| 浓度(mol/L) 时间(min) |
c(NH3) |
c(O2) |
c(NO) |
c(H2O) |
| 起 始 |
4.0 |
5.5 |
0 |
0 |
| 第2min |
3.2 |
x |
0.8 |
1.2 |
| 第4min |
2.0 |
3.0 |
2.0 |
3.0 |
| 第6min |
2.0 |
3.0 |
2.0 |
3.0 |
①反应在第2mim到第4mim时,反应速率v(O2)=
②第2min时改变了条件,改变的条件可能是
A.升高温度 B.使用了催化剂 C.减小压强 D.增加了生成物
③在相同的温度下,起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为1mol/L,则该反应将向 _______方向进行(填“正反应”.“逆反应”.“不移动”)
(4)工业上用水吸收二氧化氮生产硝酸,生成的NO2气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失),现有23吨NO2经过2次氧化吸收得到20℅的稀硝酸 吨。
(5)成品硝酸的浓度为60%~70%,为了制浓硝酸,常用Mg(NO3)2作吸水剂,然后进行蒸馏,不用CaCl2或MgCl2作吸水剂的原因是__________________________________________
 2Ca2++2K++Mg2++4
2Ca2++2K++Mg2++4 +2H2O
+2H2O


 CaCO3(s)+
CaCO3(s)+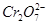 和
和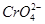 ,常用的方法有两种。
,常用的方法有两种。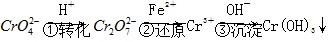 。
。
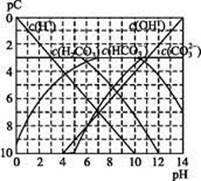
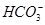 能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。 ≈ 。
≈ 。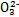 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。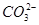 )="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
)="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。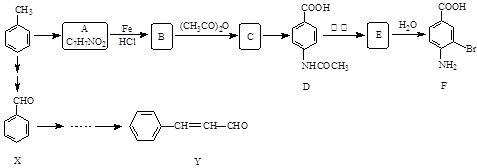
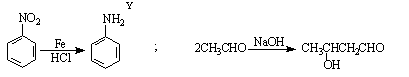
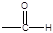

 粤公网安备 44130202000953号
粤公网安备 44130202000953号