某研究性学习小组利用下列原料和流程制备CuSO4·5H2O。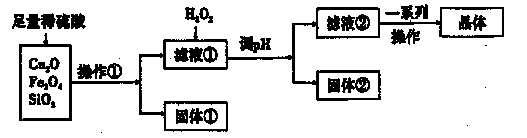
已知:Cu+在酸性条件下不稳定,易生成金属Cu和Cu2+。
(1)操作①的名称为____。 ,
(2)若固体①的成分为混合物,则其成分的化学式为____。
(3)将H2O2加入滤液①中,发生反应的离子方程式为 。
(4)调pH可选用的药品为____。
| A.NaOH溶液 | B.CuO | C.氨水 | D.CuCO3 |
(5)获得的CuSO4·5H2O晶体表面附着杂质离子,常用酒精洗涤的原因是 。
某研究性学习小组利用下列原料和流程制备CuSO4·5H2O。
已知:Cu+在酸性条件下不稳定,易生成金属Cu和Cu2+。
(1)操作①的名称为____。 ,
(2)若固体①的成分为混合物,则其成分的化学式为____。
(3)将H2O2加入滤液①中,发生反应的离子方程式为 。
(4)调pH可选用的药品为____。
| A.NaOH溶液 | B.CuO | C.氨水 | D.CuCO3 |
(5)获得的CuSO4·5H2O晶体表面附着杂质离子,常用酒精洗涤的原因是 。