某同学称取一定质量的铁粉样品(含有少量不与稀硫酸反应的杂质),放入烧杯中,加入98
稀硫酸,恰好完全反应,生成气体的质量与反应时间的关系如图所示,试回答下列问题:
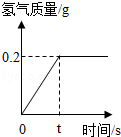
(1)根据图象,恰好完全反应时生成氢气的质量是
;
(2)样品中铁的质量是多少?稀硫酸的溶质质量分数是多少?(写出计算过程)
某同学称取一定质量的铁粉样品(含有少量不与稀硫酸反应的杂质),放入烧杯中,加入98
稀硫酸,恰好完全反应,生成气体的质量与反应时间的关系如图所示,试回答下列问题:

(1)根据图象,恰好完全反应时生成氢气的质量是
;
(2)样品中铁的质量是多少?稀硫酸的溶质质量分数是多少?(写出计算过程)