某化学兴趣小组的同学对一份固体样品进行了探究.通过实验已确定该样品由氧化铁和铁粉混合而成.他们称取了13.6
固体样品,用图1所示的装置继续实验,测定的部分数据如图2所示.
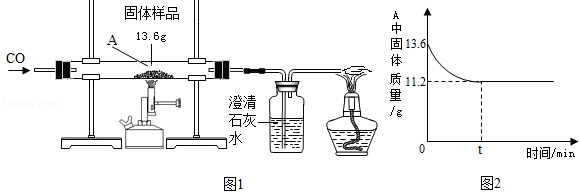
请计算:
(1)固体样品中氧化铁的质量是克.
(2)在上述反应后的固体中加入100
稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数.(结果精确到0.1%)
某化学兴趣小组的同学对一份固体样品进行了探究.通过实验已确定该样品由氧化铁和铁粉混合而成.他们称取了13.6
固体样品,用图1所示的装置继续实验,测定的部分数据如图2所示.

请计算:
(1)固体样品中氧化铁的质量是克.
(2)在上述反应后的固体中加入100
稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数.(结果精确到0.1%)