实验室制取某些气体所需的装置如图所示,请回答下列问题.
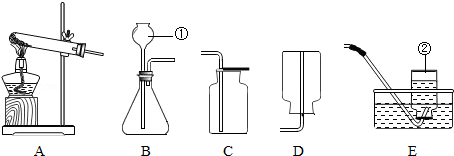
(1)仪器名称:①,②.
(2)选用A装置制取氧气的一个化学方程式为,收集氧气可选用的一种装置是(填字母).
(3)实验室制取二氧化碳气体应选择的发生装置是(填字母),制取二氧化碳的化学方程式为.
实验室制取某些气体所需的装置如图所示,请回答下列问题.

(1)仪器名称:①,②.
(2)选用A装置制取氧气的一个化学方程式为,收集氧气可选用的一种装置是(填字母).
(3)实验室制取二氧化碳气体应选择的发生装置是(填字母),制取二氧化碳的化学方程式为.