黄铁矿(FeS2)燃烧产生的SO2通过下列工艺过程既能制得H2SO4,又能制得H2。
(1)该过程中能循环利用的物质为 。
(2)在该过程中,使用膜反应器及时分离出HI分解产生的H2,目的是 (用平衡移动的原理解释)。
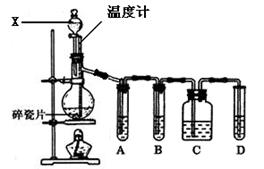
(3)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀,进行如下实验。已知浓硫酸的沸点为338℃,加热时酒灯火焰的温度为400℃~500℃。
①甲同学用装置I进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸,请解释生成该白色沉淀的可能原因 (用离子方程式表示)。
②乙同学认为甲同学的装置不完善,设计了改进装置II进行实验(夹持装置和A中加热装置已略,气密性已检查)。
a.打开弹簧夹通入N2,一段时间后关闭弹簧夹;b.滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。操作a的目的是 ,装置B中的剂是 。
③丙同学取乙实验后的C中溶液少许,滴加一种无色溶液,产生不溶于盐酸的白色沉淀,丙同学滴加的试剂可能是 (填字母编号)。
a.NaOH溶液 b.H2O2溶液 c.新制氯水 d.酸性KmnO4溶液
④装置D中与导管连接的是硬质玻璃管,则装置D的作用是 。

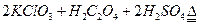
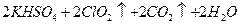
 )。饮用水中ClO2、
)。饮用水中ClO2、
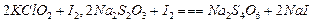 ,则步骤4中加入的指示剂为,滴定达到终点时溶液的颜色变化为
,则步骤4中加入的指示剂为,滴定达到终点时溶液的颜色变化为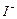 将溶液中的
将溶液中的 还原为
还原为 以测定其含量,该反应的离子方程式为:
以测定其含量,该反应的离子方程式为: 将
将 粤公网安备 44130202000953号
粤公网安备 44130202000953号