工业上以软锰矿为原料,利用烧结烟气中的SO2制备MnSO4·H2O的流程如下: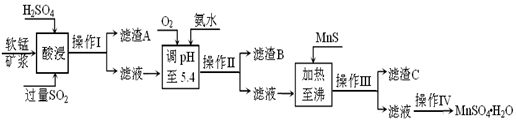
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。酸浸过程发生反应:MemOn+H+→Me(2n/m)++H2O,Me表示Fe、 Al、 Zn、 Cu等。25℃时部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
| pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥-0.42 |
≥2.5 |
≥7 |
≥7 |
回答下列问题:
(1)酸浸时SO2将MnO2还原为MnSO4,其离子方程式为 。
酸浸时SO2的吸收率与pH和温度的关系如下图,为提高SO2的吸收率,酸浸适宜的条件是 。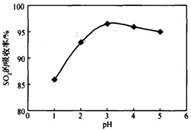
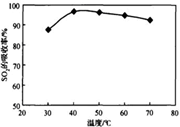
图1: SO2的吸收率与 pH值的关系 图2: SO2的吸收率与温度的关系
(2)滤渣B的主要成分是 。
(3)加入MnS的目的是 。
(4)操作IV的步骤为 、 、过滤、洗涤、干燥。
(5)MnO2的生产方法之一是以石墨为电极,在不断搅拌情况下,电解酸化的MnSO4溶液,阳极的电极反应式为: 。
(6)已知金属离子浓度小于1.0×10-5mol/L时认为已经完全沉淀,根据表格数据,计算25℃时Zn(OH)2溶度积Ksp为 (不需计算过程,计算结果保留两位有效数字)。
 R-CH="CH-R’" + HX。美国化学家Richard F. Heck因研究此反应获2010年诺贝尔化学奖。以下是利用钯催化偶联反应合成一种香料A(
R-CH="CH-R’" + HX。美国化学家Richard F. Heck因研究此反应获2010年诺贝尔化学奖。以下是利用钯催化偶联反应合成一种香料A( )的流程:
)的流程:


 ,C10H8)的衍生物,其可能具有的化学性质有________(选填编号)。
,C10H8)的衍生物,其可能具有的化学性质有________(选填编号)。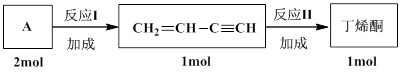
 2B(s) + 6HBr(g) 来制取晶体硼。完成下列填空:
2B(s) + 6HBr(g) 来制取晶体硼。完成下列填空: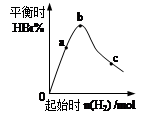
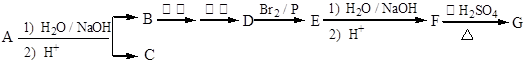
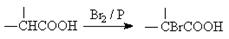
 )结构。
)结构。  粤公网安备 44130202000953号
粤公网安备 44130202000953号