今有下列气体:H2、Cl2、HCl、NH3、NO、H2S、SO2,用如图所示的装置进行实验,填空下列空白: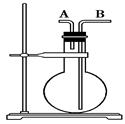
(1)烧瓶干燥时,从A口进气可收集的气体是________,从B口进气可收集的气体是______________。
(2)烧瓶中充满水时,可用来测量___________等气体的体积。
(3)当烧瓶中装入洗液,用于洗气时,气体应从________口进入烧瓶。
今有下列气体:H2、Cl2、HCl、NH3、NO、H2S、SO2,用如图所示的装置进行实验,填空下列空白:
(1)烧瓶干燥时,从A口进气可收集的气体是________,从B口进气可收集的气体是______________。
(2)烧瓶中充满水时,可用来测量___________等气体的体积。
(3)当烧瓶中装入洗液,用于洗气时,气体应从________口进入烧瓶。