稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为N2。不同空/燃比时汽车尾气中主要污染物的含量变化如下图所示。
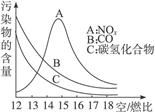
(1)稀薄燃烧技术除能节约能源外,还具有的优点是________________(填一项)。排放到大气中的NOx会导致酸雨、_____________等环境问题(填一项)。
(2)某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是__________________。

(3)若某一催化剂能同时催化NH3等还原性气体与NOx的反应。将该催化剂分别用于催化还原含等物质的量NOx的两种气体:①纯NO气体,②汽车尾气。消耗的物质的量较多的可能是______________(填字母),原因是______________。
A.①B.②C.都有可能