下表为周期表的一部分,其中的编号代表对应的元素。请回答下列问题: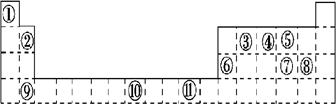
(1)表中属于ds区的元素是_____ (填编号)。
(2)  其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有 元素(填元素符号)。
其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有 元素(填元素符号)。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子成对电子为_ _对。
(4)比较下列数值的大小(选填“>”“<”“=”)
第一电离能:④ ⑤;电负性:⑦ ⑧
下表为周期表的一部分,其中的编号代表对应的元素。请回答下列问题:
(1)表中属于ds区的元素是_____ (填编号)。
(2)  其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有 元素(填元素符号)。
其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有 元素(填元素符号)。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子成对电子为_ _对。
(4)比较下列数值的大小(选填“>”“<”“=”)
第一电离能:④ ⑤;电负性:⑦ ⑧