利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化)
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦H2S ⑧SO2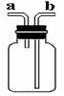
(1)若烧瓶是干燥的,则由b口进气收集的气体有 (写序号);
(2)若烧瓶充满水,可收集的气体有 (写序号)。
(3)若在烧瓶内装入浓硫酸使气体干燥,则可用此装置来干燥的气体有________,这时气体由________口进入。
利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化)
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦H2S ⑧SO2
(1)若烧瓶是干燥的,则由b口进气收集的气体有 (写序号);
(2)若烧瓶充满水,可收集的气体有 (写序号)。
(3)若在烧瓶内装入浓硫酸使气体干燥,则可用此装置来干燥的气体有________,这时气体由________口进入。